質量 パーセント 濃度 問題 応用 293999-質量 パーセン�� 濃度 問題 応用
3
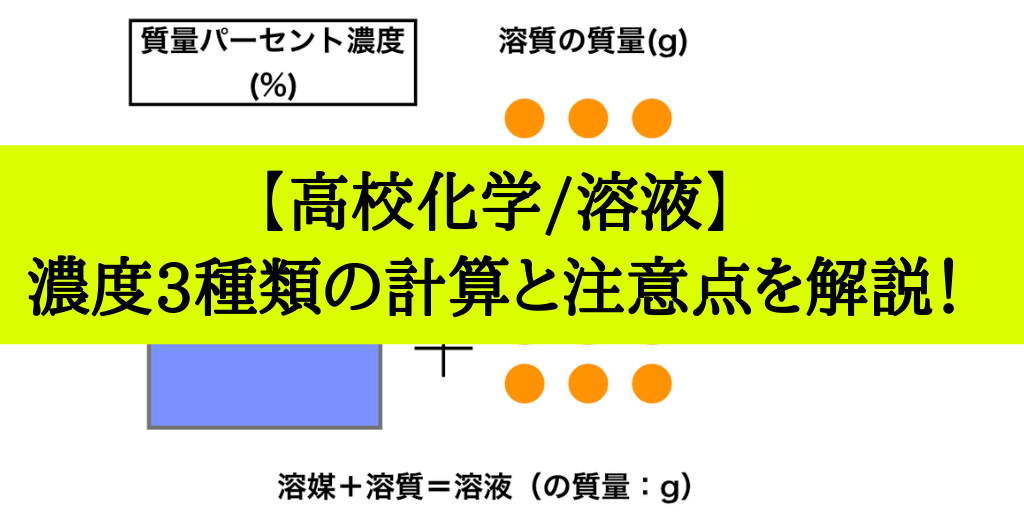
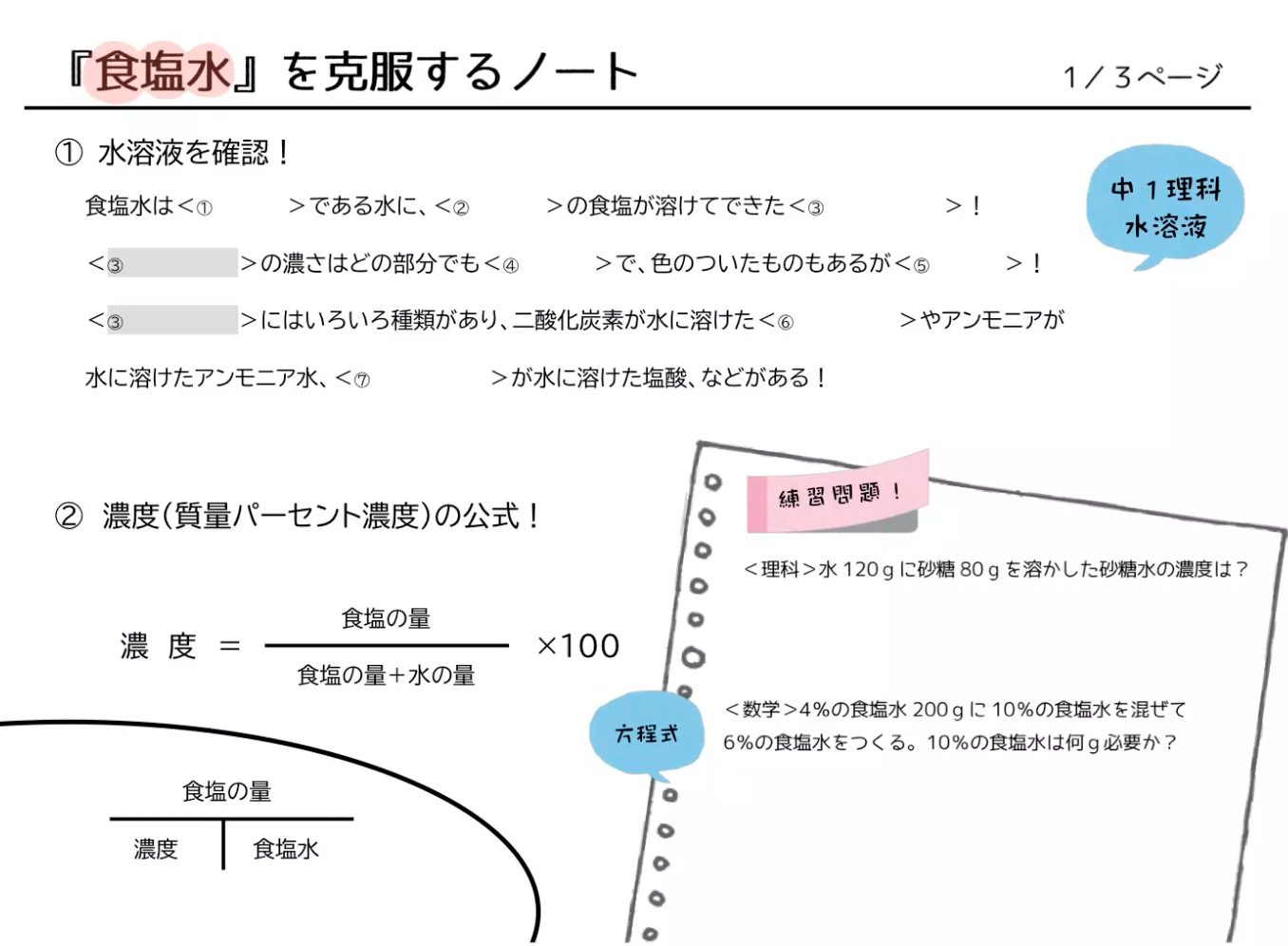
溶液 = 溶質 溶媒より 溶質= (溶質溶媒)× 質量パーセント濃度 100 溶媒をxにして方程式をつくる。 例砂糖30gをすべて使って質量パーセント濃度6%の砂糖水を作るときの水の質量を求める。 溶質= (溶質溶媒)× 質量パーセント濃度 100 なので 溶媒をxにして方程式をつくると 30 = (30x)× 6 100 3000 = 180 6x 6x = 3000 180ここを見間違えて濃度の計算を間違えることがよくあります。このことに特に注意して問題文を読むことがコツです。 質量パーセント濃度(%)= 溶質の質量(g)÷ 溶液(溶質溶媒)の質量(g)× 100 なので、(g) ÷(400)(g) × 100 答えは 48% となります。
質量 パーセント 濃度 問題 応用
質量 パーセント 濃度 問題 応用-上の基本用語をチェックして、質量パーセント濃度の公式を考えてみましょう。 質量パーセント濃度%= $ \frac{溶質の質量g}{溶液の質量g} $ ×100 この計算を見れば『溶液の質量に対する溶質の割合』だ‥と気付けると思います。 (1)の問題は 溶質 25g 質量パーセント濃度 から モル濃度 を求める場合 問題:質量パーセント濃度が40%の水酸化ナトリウム水溶液(密度140g/cm 3 )のモル濃度は何mol/Lか。 ① 溶液1Lの質量を求める 140 =(2) 1400g ② 溶質の質量を求める (2) 1400 40 /100=(4) 560g
濃度の応用
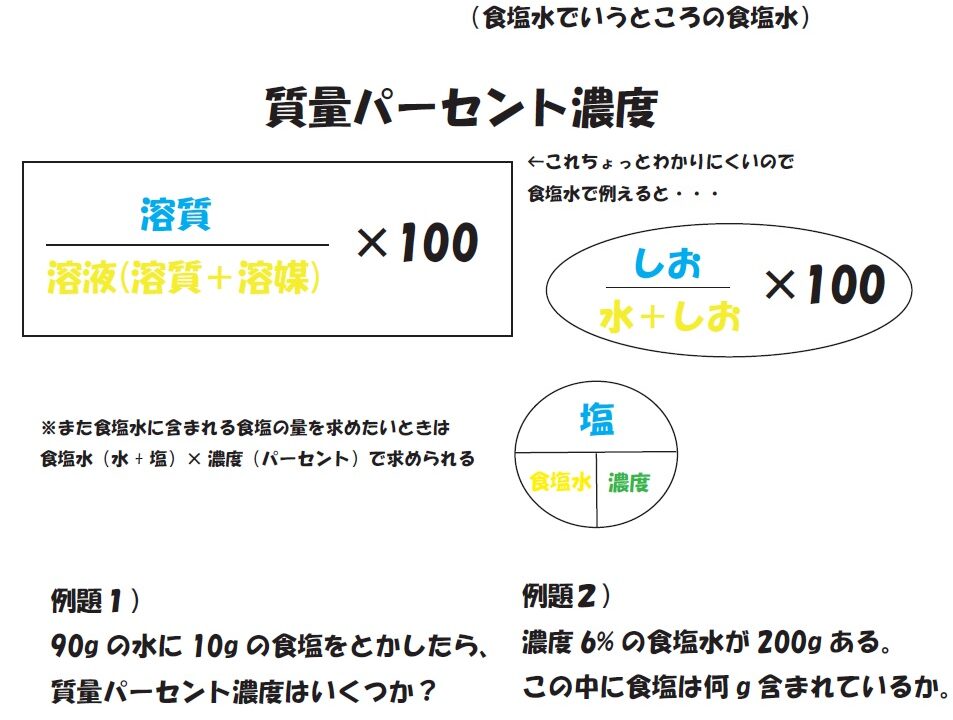
必要なのは水酸化ナトリウムの質量であり、水は邪魔ですよね。 ですから、水溶液全体10gのうち、 溶質の質量 はいくらか求めましょう。 このときに使うのは、質量パーセント濃度です。 質量パーセント濃度〔%〕= (溶質の質量〔g〕/水溶液の質量〔g〕)×100 (1) これを使うと、「溶質の質量」と「水溶液の質量」の関係がわかるわけです。 今わかっているの 質量パーセント濃度の計算問題集基本編 科学者たちは、質量パーセント濃度という基準をつくり、世界を発展させたことは学びましたよね。 具体的にいえば、 「この溶液が100gあったとき、溶質は何gあるのか? 」 を示す指標です。 水溶液には、溶質と溶媒があります。 溶媒が水であれば、水溶液とよぶ。 溶媒がエタノールなど、他の物質の場合もある濃度8%の水溶液が600gある。 この水溶液中に溶けている溶質の質量を求めよ。 。 濃度12%の水溶液を500g作るために必要な水の質量を求めよ。 48gの物質を全てとかして、濃度6%の水溶液を作るために必要な水の質量を求めよ。 水230gを全て使って濃度8%の水溶液を作るために必要な溶質の質量を求めよ。 15% 8% 33% 48g 440g 752g g
質量パーセント濃度(%)= 溶質の質量(g)÷ 溶液(溶質溶媒)の質量(g)× 100 なので、(g) ÷ 400(g) × 100 答えは 5% となります。中1数学の方程式文章題を例題と練習問題で徹底的に練習 はじめにあった0gの食塩水の濃度をx%とする。 x%の食塩水0gに含まれる食塩は 0× x 100 =2x 10%の食塩水300gに含まれる食塩は 300× 10 100 =30 0gと300gを混ぜるのでできた8%の食塩水は500gである。 8%の 質量パーセント濃度とは 次は"質量パーセント濃度"にうつりましょう。 単位:g/g→% $$\frac{溶質の質量(g)}{溶液の質量(g)}\times 100=\%$$ これも非常に単純で、溶液の質量(g)を分母、溶質の質量(g)を分子に持って来た上で「割合」を求めます。
質量 パーセント 濃度 問題 応用のギャラリー
各画像をクリックすると、ダウンロードまたは拡大表示できます
 4 6 溶液の濃度 おのれー Note | 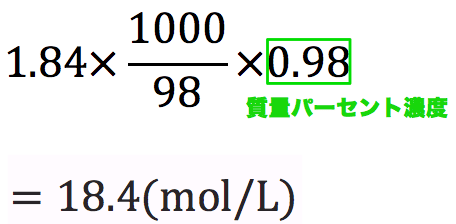 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |
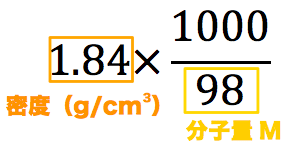 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note | 4 6 溶液の濃度 おのれー Note | 4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note | 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note | 4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note | 4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note | 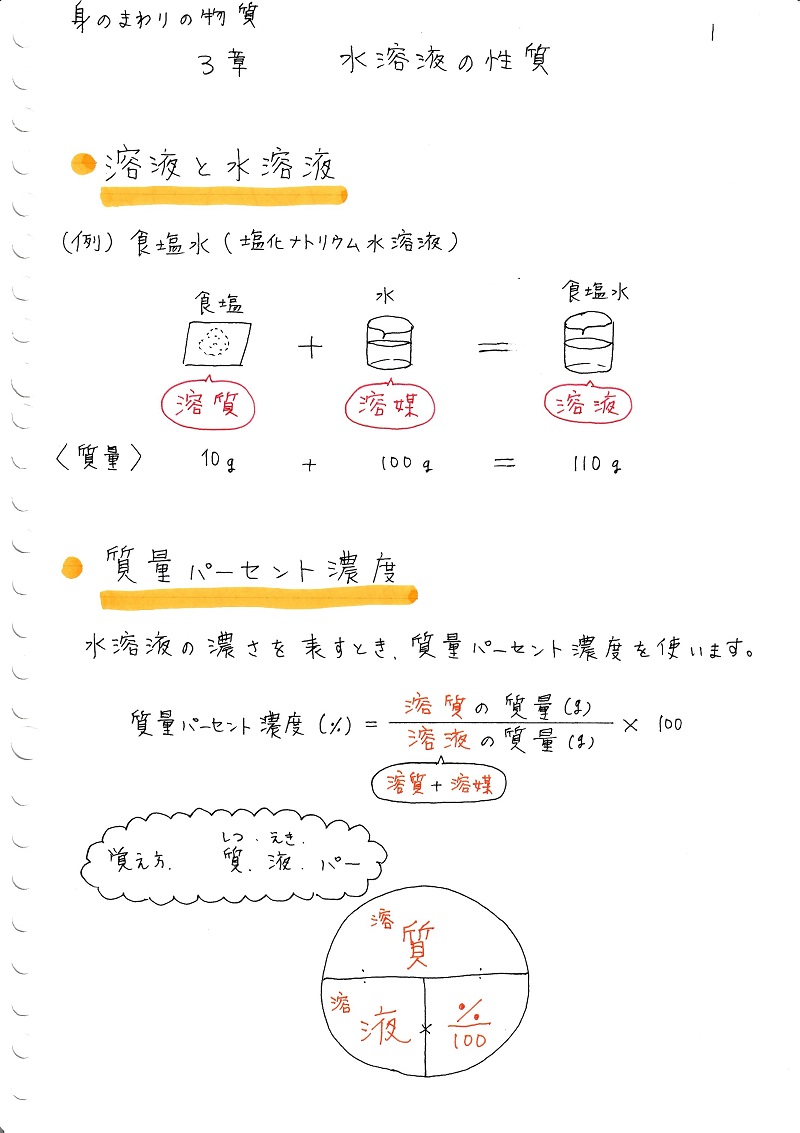 4 6 溶液の濃度 おのれー Note | 4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note | 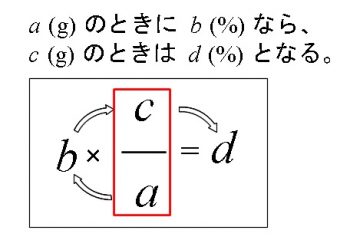 4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note | 4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note | 4 6 溶液の濃度 おのれー Note | 4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note | 4 6 溶液の濃度 おのれー Note |
4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note | 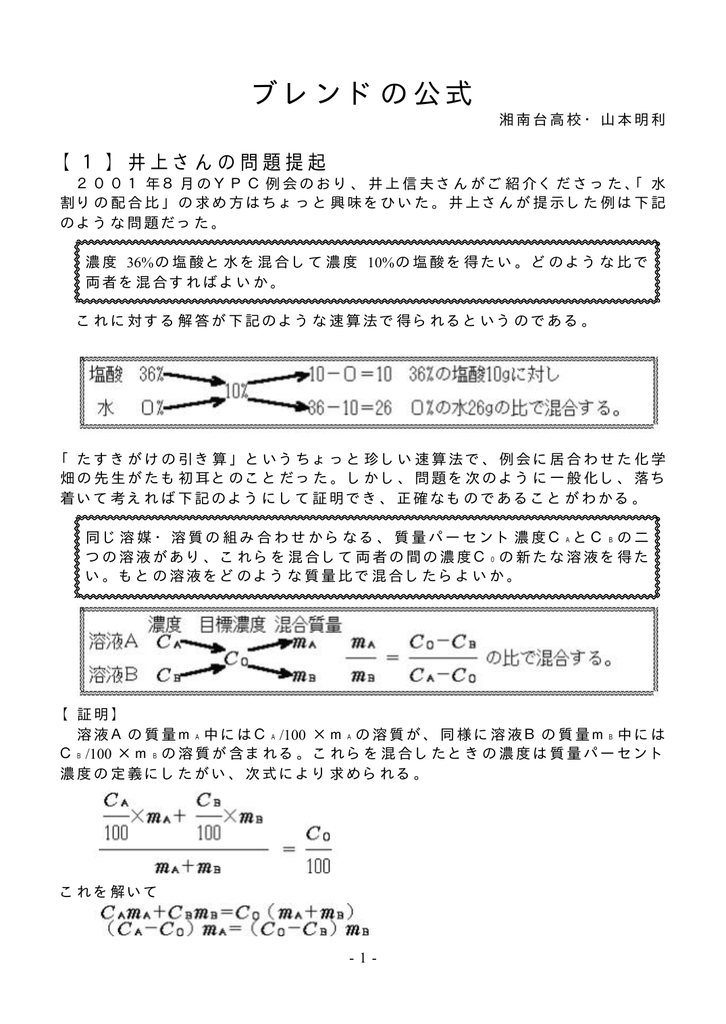 4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note | 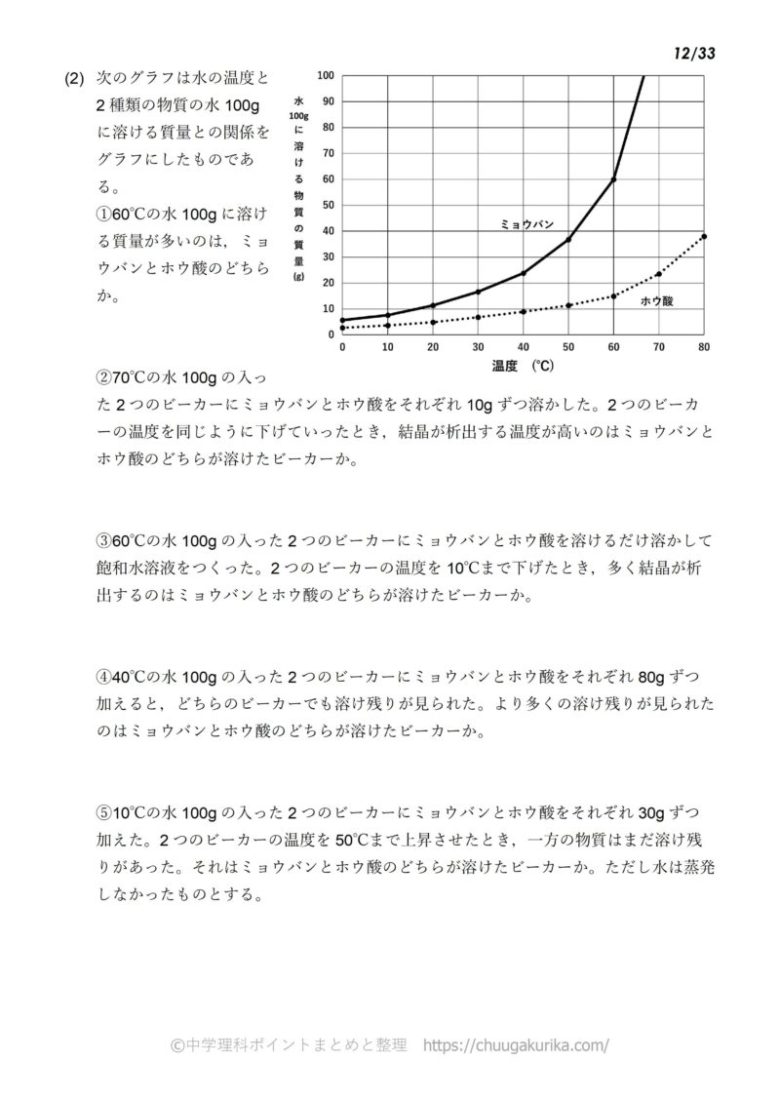 4 6 溶液の濃度 おのれー Note | 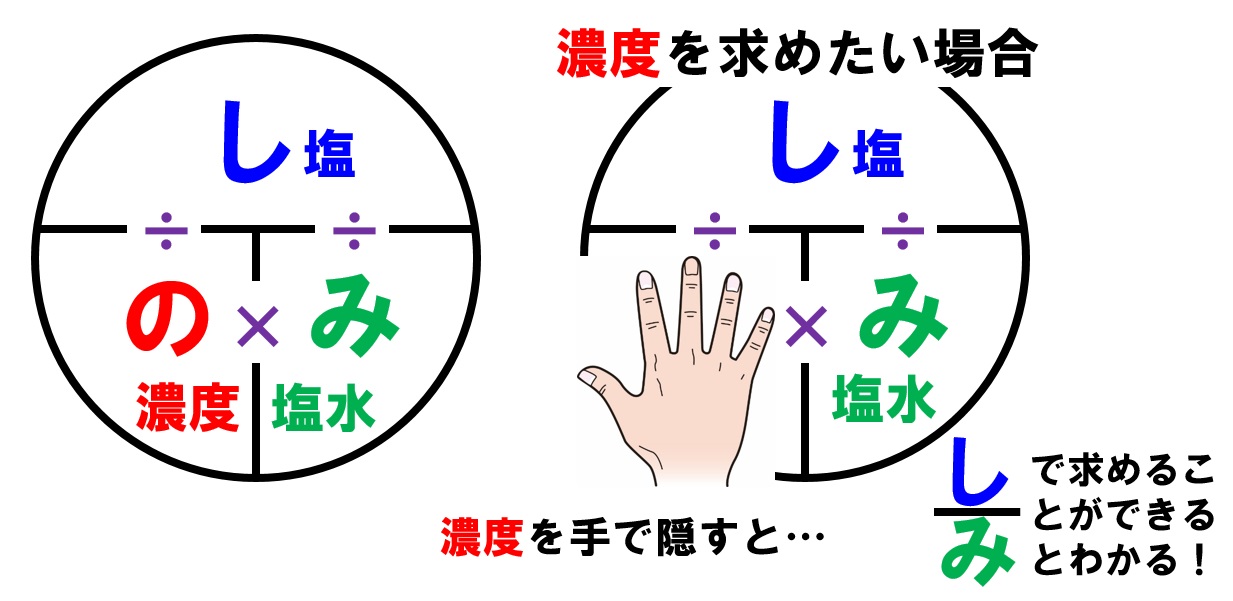 4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note | 4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note | 4 6 溶液の濃度 おのれー Note | 4 6 溶液の濃度 おのれー Note |
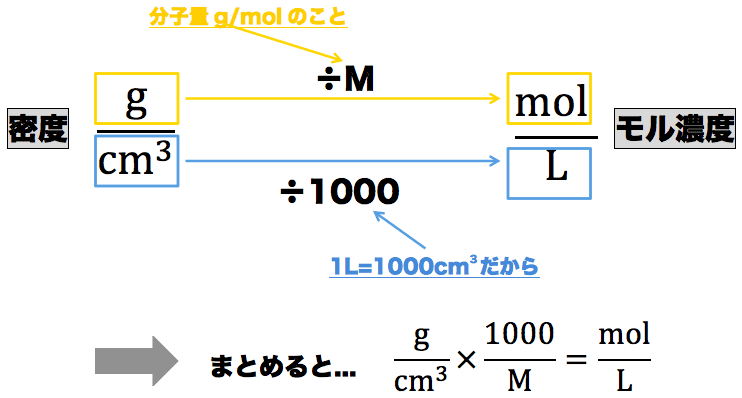 4 6 溶液の濃度 おのれー Note | 4 6 溶液の濃度 おのれー Note | 4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note | 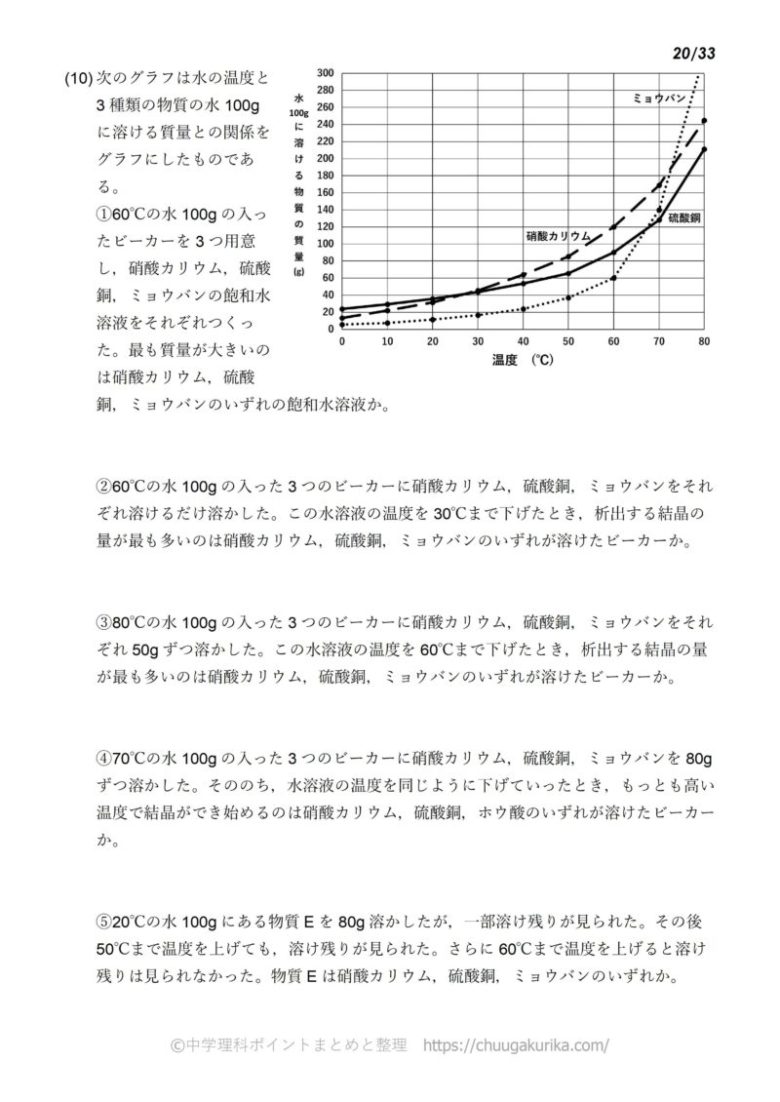 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note | 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note | 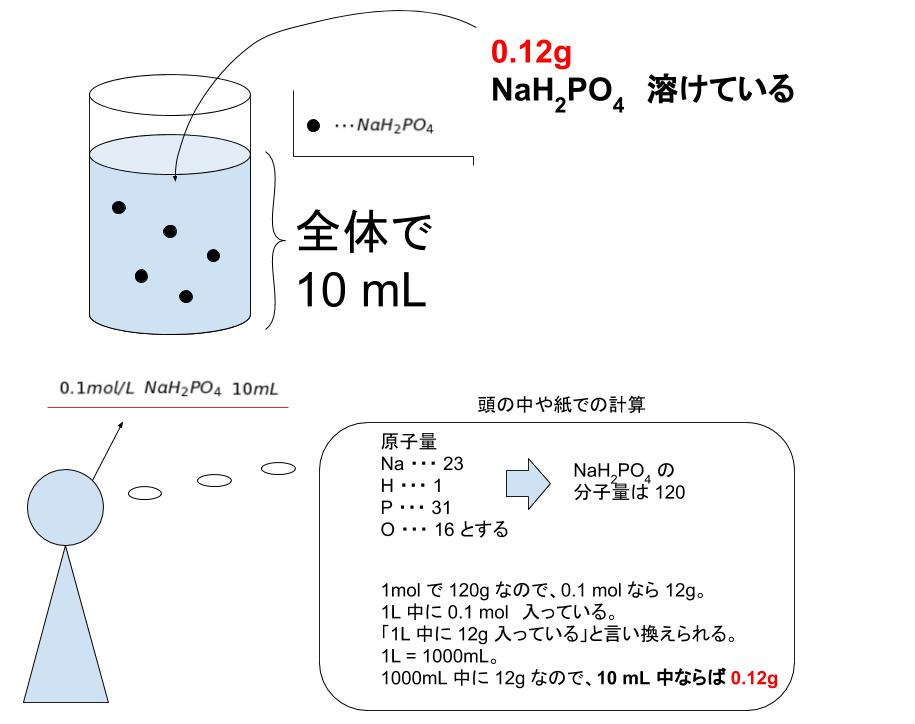 4 6 溶液の濃度 おのれー Note |
 4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |  4 6 溶液の濃度 おのれー Note |
4 6 溶液の濃度 おのれー Note | 4 6 溶液の濃度 おのれー Note |
至急理科の質量パーセント濃度の応用について 至急理科の質量パーセント濃度の応用について以下の問題の解き方お願いします。 次のA&#;Dのような食塩水をつくった。 A:50gの水に10gの食塩を溶かした。 B:100gの水に25gの食塩を溶かした。6%の食塩水150gにとけている食塩の質量は 水溶液全体の質量は 150(g)+50(g)=0(g) 0gの食塩水に9gの食塩がとけているので、濃度の公式より、 答えは 4.5%
Incoming Term: 質量 パーセント 濃度 問題 応用,
コメント
コメントを投稿